Белки́ (протеи́ны, полипепти́ды[1]) — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций создают молекулы белков с большим разнообразием свойств. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например фотосинтетический комплекс.
Кристаллы различных белков, выращенные на космической станции «Мир» и во время полётов шаттлов НАСА. Высокоочищенные белки при низкой температуре образуют кристаллы, которые используют для изучения пространственных структур этих белков.
Функции белков в клетках живых организмов более разнообразны, чем функции других биополимеров — полисахаридов и ДНК. Так, белки-ферменты катализируют протекание биохимических реакций и играют важную роль в обмене веществ. Некоторые белки выполняют структурную или механическую функцию, образуя цитоскелет, поддерживающий форму клеток. Также белки играют ключевую роль в сигнальных системах клеток, при иммунном ответе и в клеточном цикле.
Белки — важная часть питания животных и человека (основные источники: мясо, птица, рыба, молоко, орехи, бобовые, зерновые; в меньшей степени: овощи, фрукты, ягоды и грибы), поскольку в их организмах не могут синтезироваться все незаменимые аминокислоты и часть должна поступать с белковой пищей. В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются для биосинтеза собственных белков организма или подвергаются дальнейшему распаду для получения энергии.
Определение аминокислотной последовательности первого белка — инсулина — методом секвенирования белков принесло Фредерику Сенгеру Нобелевскую премию по химии в 1958 году.
Первые трёхмерные структуры белков гемоглобина и миоглобина были получены методом дифракции рентгеновских лучей, соответственно, Максом Перуцем и Джоном Кендрю в конце 1950-х годов[2][3], за что в 1962 году они получили Нобелевскую премию по химии.
Содержание 1 История изучения
2 Свойства 2.1 Размер
2.2 Физико-химические свойства 2.2.1 Амфотерность
2.2.2 Растворимость
2.2.3 Денатурация 3 Структура 3.1 Уровни организации 3.1.1 Первичная структура
3.1.2 Вторичная структура
3.1.3 Третичная структура
3.1.4 Четвертичная структура 3.2 Классификация по типу строения
3.3 Простые и сложные белки
3.4 Биофизика белка 4 Синтез 4.1 Биосинтез 4.1.1 Универсальный способ: рибосомный синтез
4.1.2 Нерибосомный синтез 4.2 Химический синтез 5 Посттрансляционная модификация
6 Жизненный цикл 6.1 Внутриклеточный транспорт и сортировка
6.2 Поддержание структуры и деградация 6.2.1 Шапероны
6.2.2 Протеолиз
6.2.3 Аутофагия
6.2.4 JUNQ и IPOD 7 Функции белков в организме 7.1 Каталитическая функция
7.2 Структурная функция
7.3 Защитная функция
7.4 Регуляторная функция
7.5 Сигнальная функция
7.6 Транспортная функция
7.7 Запасная (резервная) функция
7.8 Рецепторная функция
7.9 Моторная (двигательная) функция 8 Белки в обмене веществ
9 Методы изучения 9.1 Молекулярной и клеточной биологии
9.2 Биохимические
9.3 Протеомика
9.4 Предсказание структуры и моделирование 10 См. также
11 Примечания
12 Литература
13 Ссылки
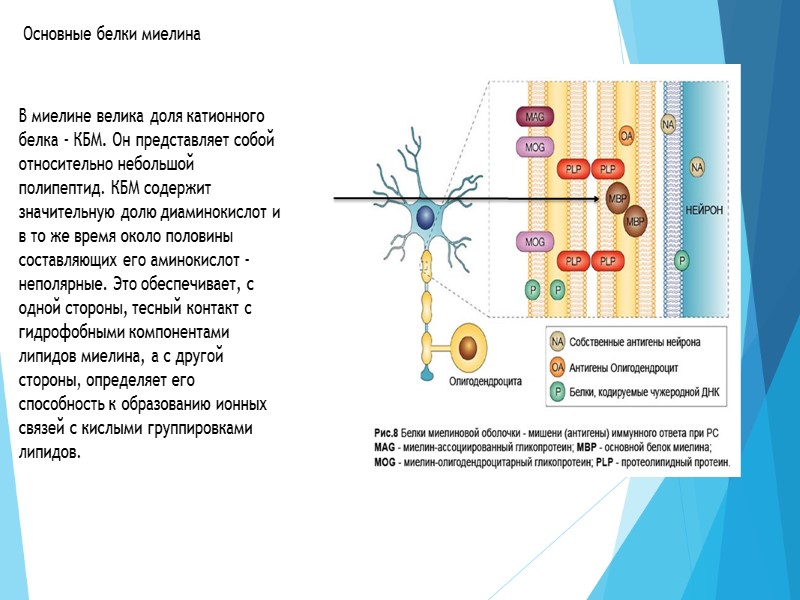
Белки нервной системы
