Ферме́нты (от лат. fermentum) или энзи́мы (от греч. ζύμη, ἔνζυμον «закваска»), — обычно достаточно сложные молекулы белка, РНК (рибозимы) или их комплексы, ускоряющие химические реакции в живых системах. Каждый фермент, свернутый в определённую структуру, ускоряет соответствующую химическую реакцию: реагенты в такой реакции называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам: АТФ-аза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу.
Ферментативная активность может регулироваться активаторами (повышаться) и ингибиторами (понижаться).
Белковые ферменты синтезируются на рибосомах, а РНК — в ядре.
Термины «фермент» и «энзим» давно используют как синонимы: первый в основном в русской и немецкой научной литературе, второй — в англо- и франкоязычной.
Наука о ферментах называется энзимологией, а не ферментологией (чтобы не смешивать корни слов латинского и греческого языков).
Содержание 1 История изучения
2 Функции ферментов
3 Соглашения о наименовании ферментов
4 Классификация ферментов
5 Кинетические исследования
6 Структура и механизм действия ферментов 6.1 Активный центр ферментов
6.2 Специфичность 6.2.1 Модель «ключ-замок»
6.2.2 Модель индуцированного соответствия 6.3 Модификации
6.4 Кофакторы ферментов
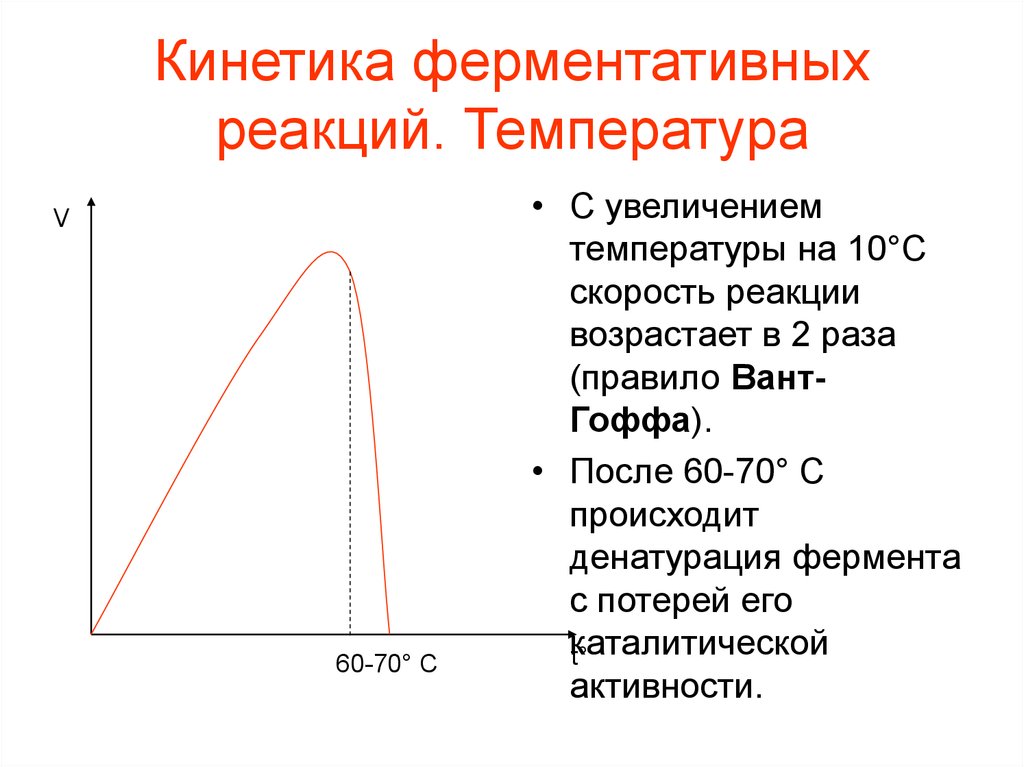
6.5 Влияние условий среды на активность ферментов 7 Регуляция работы ферментов 7.1 Ингибирование
7.2 Активирование
7.3 Ковалентная модификация 8 Множественные формы ферментов
9 Медицинское значение
10 Практическое использование
11 Примечания
12 Литература
Кинетика действия ферментов
